COVID-19の感染拡大により、その治療薬やワクチン開発に注目が集まっています。今回は治験情報提供プラットフォームで患者マッチングサービスを運営するBuzzreach代表猪川さんに、治療薬やワクチンの開発がどのように進められているのか、また、COVID-19の影響で治験は、医薬品開発環境はどのように変わっていくのかインタビューを実施しました!(Buzzreach社はCOVID-19感染回復者とワクチン開発への協力を募るコホートサイトをオープンしている)

聞き手:さっそくですが、そもそもの治験のフローはどうなっているのでしょうか?
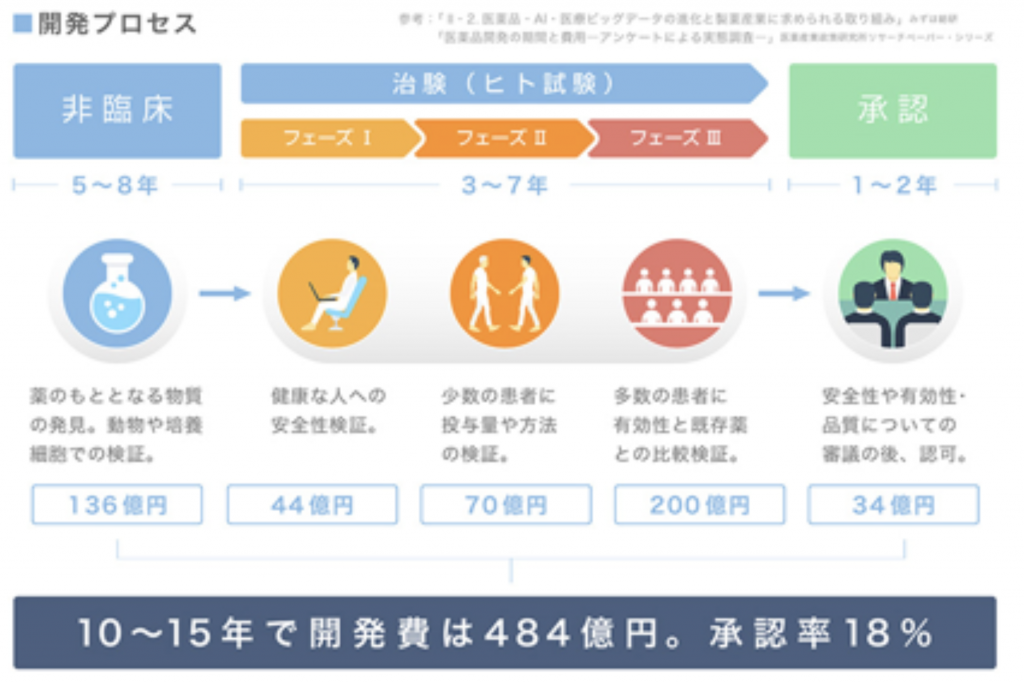
まずは治験の前に非臨床というプロセスがあります。いわゆる薬のタネを発見するプロセスです。薬のタネになろうものが発見されたら、それをサイエンス的に実証して、問題なければ動物での検証を行います。このプロセスで人間に使っても害がないことが確認されれば承認を得るために必要な『治験』のプロセスに入っていきます。
聞き手:治験プロセスの中でもフェーズによる違いはどのようなものでしょうか?
治験はフェーズ1からフェーズ3まで、3段階のプロセスに分かれています。基本的にこのプロセスを踏まないと薬としては承認されません。多くの人が治験としてイメージしているのがフェーズ1というプロセスです。
フェーズ1では、まずは、健康な方(主に成人男性)に対して薬を投与します。その薬の薬物動態と言って人間の体をその薬物がどのように循環するのか、血中の成分濃度の推移がどうかなどを確認します。同じ薬であっても例えば日本人とアメリカ人では食文化も体格も違うので、人種によって日本では5mmg、アメリカでは10mmgとわかれます。フェーズ1が終わると、ようやく本来この薬が効果を発揮できる病気で治療中の患者さんに対して治験薬を投与します。
これがフェーズ2です。実際にその病気で治療中の患者さんを製薬企業が治験を実施するために選定した病院から医師経由で集めて(その病院に罹っている患者が対象)、治験薬を使用してもらい、安全性に問題がないか、適切な容量がどの程度か、意図した治療効果が出るかをみていきます。
聞き手:最後のフェーズ3ではどのようなことを確認するのでしょうか?
フェーズ2で意図していた結果がでると、本当に小さな副作用とかを見逃していないか、効果の確認をしていきます。そのため、フェーズ3は大規模な人数でみていきます。最大で数千とか、世界規模の同時治験(国際共同治験)とかになると万単位の患者さんで治験を世界同時におこなうこともあります。これだけ多くの患者さんに試して、安全性の確認と、意図していた効果がでるかどうかを試すのがフェーズ3。ここで意図していた結果が出ると、承認申請へと進みます。日本だと厚生労働省直下の医薬品医療機器総合機構(PMDA)が管轄。そこで書類をもろもろ提出して、承認されると薬価という薬の価格が決まり、医師からの処方が可能になります。
聞き手:各国での承認プロセスは違うのでしょうか?
治験薬の承認を取りたい国で一斉に始まりますが、承認のプロセスは国ごとに異なります。例えば、アメリカ、イギリス、中国、韓国、日本など、この薬で承認をとったらマーケットがあるだろうとスポンサーの製薬企業が決めた国で一斉にスタートします。そのプロジェクト全体で例えば、仮に1000例の患者のデータを取りましょうとなると、アメリカ500、イギリス200、日本100..みたいな感じで人口比率などによって必要症例数が配分されます。全ての国での患者さんが治験を完了次第、各国毎に承認申請のプロセスに入っていきます。
聞き手:治験のプロセスに関してはかなり理解が進みました。レムデシビルが5/7に承認され、その他、アビガンなどがCOVID-19の治療薬候補として注目されていますが、この開発状況いかがでしょうか?
日本(メイドインジャパン)だとアビガン(富士フィルム富山化学)やイベルメクチン(MSD:旧万有製薬)が有力候補といわれています。(最速では米ギリアド社のレムデシビルが5/7に承認)富士フィルム富山化学が開発しているアビガンは元々は新型インフルエンザの治療薬、MSDのイベルメクチンは北里大学の大村智特別栄誉教授が静岡県内で採取した土から発見した物質を元に開発された抗ウイルス剤です。
アビガンのCOVID-19適応承認のために冒頭で説明した治験のプロセスを踏むとなれば、無論とんでもない時間がかかります。そんなことはしていられないのが現実。COVID-19に効く新しい薬のタネとなるものは何かと探し始めて、治療薬ができるまで5年かかりましたでは意味がありません。もともと近しい病気で使用されていた治療薬等をCOVID-19にも効くのではないかと適用を拡大する形で探し始めています。
実際そこにAIテックで人力ではなくAIで可能性のある薬の候補を探すような企業(例:UKのHealx社など)が海外にあります。アビガンもそのような形で、COVID-19に治療効果があると可能性が出たため、政府も後押しをしてアビガンのCOVID-19適応のための観察研究が始まりました。COVID-19だからはあるかもしれませんが、今回のように、一般の方が新薬の開発に興味を示してもらえるようになったのは製薬業界ではポジティブに捉えてます。
聞き手:初めて興味を持った方も多いでしょうね。ちなみに最短でどれくらいで承認プロセスを突破できるのしょうか?
アビガンは政府の後押もあり、第3相試験という最終段階のところからスタートしています。症例データが500例集まり意図していた効果が確認できれば、早ければ5月中には治験が終了し特例承認する予定となっています。(5月中はなくなりましたね)
アビガンについては、新たに色々な意見も出てきているので、少し流れが変わる可能性もあります。政府の後押しがキーワードで、特例の早期承認があり、通常の承認プロセスだと最低でも多くは1年以上かかりますが、そこを数ヶ月で承認までもっていくことが可能となります。COVID-19治療薬は最優先で国が承認するので、早ければこの5月以降幾つかの薬剤で承認が出て治療薬として使えるようになる可能性があります。
聞き手:実際にアビガンなどの治験フローの課題はあるのでしょうか?
通常の治験と比べるとという意味(承認までのプロセス)では課題はあまりありません。これだけ政府が後押しして、すべてにおいてサポートされながら進んでいて、早期承認も期待されメディアも常に世の中にデータを発信できています。この状態を他の治験でも近い環境にできればなと考えています。さすがにここまでじゃないにしろ、他の医薬薬開発でも一般の方へ開発状況をオープンに知ってもらい、興味関心を持ってもらえるようなプラットフォームを我々は創っていくことで、患者さんのため医療の未来のために貢献できると改めて感じました。
聞き手:スムーズにすすんでいるのは、PMDAのやり取りの速さ、治験を実施する企業が実施しやすい状況があると思いますが、病院サイドの理解もあるんでしょうか?
唯一の課題があるとすればその部分です。治験で協力が必要な医師やコメディカルスタッフがそもそも通常診療で多忙ため治験まで手が回らない、医療物資やベッドの確保の難しさなどがあります。通常診療が優先なので治験をしないとアビガンなどの治療薬が承認されないというのがわかってていても、当たり前ですがどうしても通常診療が優先。治験は後手後手になってしまいます。日本の治験の場合はいわゆる皆さんが普段罹られている一般の病院で治験をやるのでこうなってしまいます。例えば、韓国だと、国策として治験を誘致しているので、それを実現するために指定の基幹病院に対して国が治験設備のための予算を年数億円出します。韓国にいくと大学病院や日本でいう企業病院に当たるSAMSUNG(サムスン)病院などには治験専用の病棟や医師、スタッフ、設備があったりします。
聞き手:アビガンなどの治療薬に関しては早期承認が期待できそうですね。治療薬と比較してワクチンの開発は違いがあるのでしょうか?
アビガンやレムデシビルは治療薬なので今感染している人に対して投与することで完治を目指します。ワクチンは防御の方。ワクチンを作るためにはCOVID-19を乗り越えた人の抗体などが必要です。ワクチンをより早く作るために毒性のないCOVID-19に近いもの(擬似的なウイルス)を人工的に作り、それを使い人での治験を行います。人間は一度入ってきたウィルスに対する抗体ができるので、同じものが入ってきても症状を抑えてくれる。これがワクチンの元素になります。基本的なワクチンは実際にCOVID-19に感染して回復した人の血液を採取し、その血液から研究をはじめ、抗体研究からワクチンをつくっていきます。
そこでワクチン最有力候補の一つとなっているのが、国内だと内資最大手の武田薬品工業の免疫グロブリン製剤や塩野義製薬の昆虫細胞を使用した製剤、外資最大手の米ファイザー社のワクチンで、中でも米ファイザー社のワクチンは早ければ2020年9月にも承認される可能性があります。治験実施医療機関を支援するSMO事業が母体であるアイロムグループでもワクチンの開発を中国での共同開発で開始していたりします。
聞き手:治療薬とワクチンの治験のフローは違いがあるのでしょうか?
ワクチンの場合はワクチン候補を作るために、まずは抗体保持者の血液検体を収集やワクチン候補ができた際にワクチンで防御するウイルスを擬似的に作る点などに違いがあります。実際に感染から回復した人の抗体やワクチン候補が完成した際の投薬協力者を集めなければいけません。感染回復者を募集して抗体を確認する作業をし(臨床研究など)、抗体からワクチンの候補を作るか、ウイルス自体を入手してワクチン候補を作ってから治験にはいります。
ワクチンの治験では、ワクチン候補を一般の人に投与して、抗体が機能するかを確認していきます。治療薬と比べると、ワクチンの方が基本的には時間はかかります。本来は早くてもワクチンが出るまでには一年以上はかかるでしょうが、今回は世界を脅かすウイルスと言うこともあり、ワクチンも早期開発、早期承認される可能性は高いです。実際に上述であげた候補ワクチンを開発する製薬メーカーは2020年中に治験を実施する見込みですので、早ければ5/7に薬事申請から3日という異例の早期承認をされたレムデシビルのように早々に承認され、来年の同時期にはワクチンが皆さんの手元に届く可能性もあります。
特に延長されたオリンピックがあるので、来年のこの時期の前にはワクチンが承認、利用できることが日本としては急務になります。ワクチンが承認されていなければ来年のオリンピック開催すら危ういかもしれません。
聞き手:そうなのですね。ワクチンは治療薬と比較するとかなり時間がかかりそうですね。BuzzreachではCOVID-19に関してなにか取り組みはするのでしょうか?

COVID-19感染回復者とワクチン開発への協力を募るコホートサイトを作成し、運用開始しました。
COVID-19に対する様々な治験を含む研究やマーケット調査、患者調査などに備えてパネルを含めて専門データベースを作っていくという取り組みです。このデータベースにはCOVID-19に感染し、回復した方やワクチン開発への協力志願者が登録できます。”COVID-19に感染した方にしかできない協力”や”早期ワクチン承認のために何か協力したい方”のを事前に未来の医療のために募り、これをワクチン開発などに活かしていきたいです。
COVID-19に感染した方やワクチン開発への協力志願者がここに登録(DB化)されていると、ワクチンの開発のため製薬企業や研究機関へ、このデータや検体、被験者をコホート登録者の許諾を得て提供することが可能になります。
レムデシビルのような”治療薬”はやはり治療中の患者が対象に治験が行われるため、被験者となりうる治療中の患者はCOVID-19の治療指定病院にいますが、回復してしまえば、基本退院した患者との連絡手段は無いのが現状です。
ここは何かしらプラットフォーム的な考え方が必要と考え、この取り組みをスタートしました。また、元々の我々のミッションでもある医薬品開発情報を一般の方にもわかりやすく伝えていくという部分も、COVID-19の治療薬やワクチン開発状況をこのコホートサイト内でも発信していくことを通じて、実現していこうと思います。
聞き手:COVID-19感染回復者・ワクチン開発協力志願者のコホートサイト作成は素晴らしい取り組みですね。ワクチン開発の早期化を期待しています。それでは最後になりますが、COVID-19はこれからの治験業界にどのような影響を与えるのでしょうか?
現状、COVID-19以外の治験は、1/3ほどが新しい治験をストップしている状況で、一歩先は真っ暗です。しかし、様々な病気で闘っている患者さんのためにも業界全体が下を向いていてはいけません。特に我々のように柔軟に動ける機動力のある業界スタートアップが何かアクションしなければ道が開かれません。遅かれ早かれ、すべての治験は再開されます。
ポジティブなところでいうと、業界全体がこの状況になってIT化ができていればもっと治験を進められたのではないか、治験を止めずに進められる手段があるのではないかという考えなってきています。もともとの議論のテーマとしてもありましたが、”テクノロジーでいかに治験を円滑にしていくか”がより今後は進んでいくと思います。COVID-19の影響でアナログ的なところ、グローバルに遅れをとっていたところ、一般の方への治験情報、開発情報のあり方が解決、変化していきます。
治験を実施する病院に行けないまたは行きたくない患者さんの検査をバーチャル環境でどう担保できるか、一般診療同様にICTをベースとし、IoTをどう組み込んでいくか、遠隔診療や訪問型治験をどう進めるか、もっともっとCOVID-19同様に他の治療薬への興味関心をどう一般の方へ正しくわかりやすく伝え、理解、把握してもらうか、患者中心の治験、医薬品開発をITと連動させて本格参入していくかなど、様々な観点で本格的に議論、導入検討が製薬業界では進むと思います。

2019年10月にすでにローンチ済みの治験参加患者を支援するアプリ『ミライク・スタディコンシェルジュ』ではアプリを通じて、医師に代わって治験のサポートをしてくれる治験コーディネーター(CRC)と患者さんとのコミュニケーション円滑化や服薬管理サポート機能、日常的な患者アウトカム情報の取得機能などを第一弾としてスタートしています。将来展望としては、遠隔診療連携や訪問型治験に備えた訪問診療連携、医療機器IoTデバイス連携をできるようにしていきます。IoTで血圧や体温、心拍数などの数値がオートメーションに取得できるなど本来なら病院に行かなければできなかったことがこのアプリの中でできるようにしたいと考えています。
聞き手:スタディコンシェルジュを通じた治験プロセスのデジタルトランスフォメーションはワクワクしますね。猪川さんこの度はインタビューをお受けいただきありがとうございます。COVID-19に対する国内の治療薬やワクチンの開発状況や治験業界がCOVID-19によってどのように変わっていくのかが非常にわかりやすく理解できました!
最後に、Buzzreachでは治験業界、患者中心医療の未来を一緒に創っていくエンジニアを募集しています。興味がある方はこのリンクをご確認ください。








